- Giải Hóa Học Lớp 12
- Sách giáo khoa hóa học lớp 12
- Giải Hóa Học Lớp 12 Nâng Cao
- Giải Sách Bài Tập Hóa Lớp 12
- Sách Giáo Viên Hóa Học Lớp 12
- Sách Giáo Viên Hóa Học Lớp 12 Nâng Cao
- Sách Bài Tập Hóa Học Lớp 12
- Sách Bài Tập Hóa Học Lớp 12 Nâng Cao
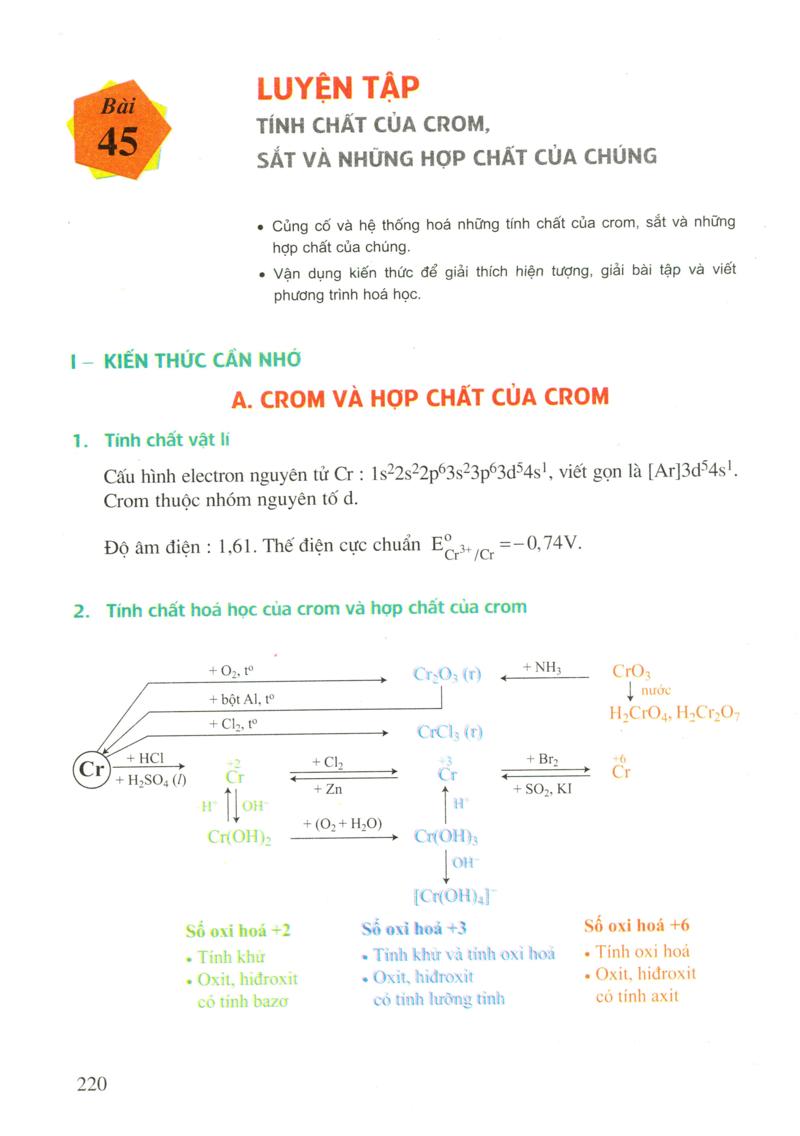
Củng cố và hệ thống hoá những tính chất của Crom, sắt và những hợp chất của chúng. Vận dụng kiến thức để giải thích hiện tượng, giải bài tập và viết phương trình hoá học. Tính chất vat 11 Cấu hình electron nguyên tử Cr:1s^2s^2p°3s°3p^3d°4s”, viết gọn là [Ar]3d54s”. Crom thuộc nhóm nguyên tố d. Độ âm điện : 1.61. Thế điện cực chuẩn Εί, οι = — 0,74V. 2. Tính chất hoa học của Crom và hop chất của Crom + O rio Creos (r) . “N” || CrO nu r til HCl . + Br. + HSO () o R. Gr + Z + SO2, KI(OHO сон —“”, снфн.croll, số oxi hoá +2 số oxi hoá +3 số oxi hoá +6 – The S S S S S SS SS SSLSLSS SGGSS S S S S S SLS GSGS SLSS L – Ο ιστον ι – Ο ΧΙΙ για το ΧΙΙ – ΟΧΙΙ για τον ΙΙ that cỏ tình lưỡng tình có tính axit B. SẤT VA HOP CHẤT CỦA SẤT 1. Tinh chất vật liCấu hình electron nguyên tử Fe : 1s^2s^2p63s°3p^3d64s”, viết gọn là [Ar]3d“4s”. Sắt thuộc nhóm nguyên tố d. Độ âm điện : 1.83.. . to – – . L: Ꭴ Thế điện cực chuẩn : / = -0.44V : |- — + 0,77 V.2. Tính chất hoá học của sắt và hop chất của sắtFe3O4 (r) + không khí và nước Fe O. XHO (II) 3 .¬ ¬ . . . . . . . ¬ ¬ ܝ ܕTe || || N + HCl, H2SO4 (l) – C. ! KMino,+ dd muổi e + Fe, + Cu, + KI Fe (dd) H,O Fe’OH), + dd HNO3 H2SO4 đặc nóng, dd AgNO3 Fe (old) số oxi hoá +2 Số oxi hoá +3 − 1 }nh khu – ΤίΠΗ ΟΧΙ 101 – Ο Χιτ. Πιάτο.Χίτε ότι ηl baαν + (}xit, hidroxit có tính bazơ3. Hop kim của sắt – Thành phần của gang và thép.- Các phản ứng hoá học xảy ra trong quá trình luyện gang và thép. 2.3.4.5.222BAITAP Cho phương trình hoá học:2Cr + 3Sno” —> 2Cro+ + 3Sn Câu nào sau đây diễn tả đúng vai trò của các chất ? A. Cr là chất oxi hoá, Sno” là chất khử B. Cr là chất khử, Sno là chất oxi hoá C. Sno là chất khử, Cro” là chất oxi hoá D. Cro” là chất khử, Sno là chất oxi hoá.Kim loại trong cặp oxi hoá – khử nào sau đây có thể phản ứng với ion Nio” trong cặp Ni?”/Ni ?A Pb2+/Pb B. Cu2/Cu C. Տո2+/Sn D. Cr3/C.o Trong phản ứng : Fe + H2SO4 đ – Fe2(SO4)3 + H2O + SO2 Có bao nhiêu nguyên tử Fe bị oxi hoá và bao nhiêu phân tử H2SO4 bị khử ?A. 2. Và 3 B, 1 Va 1C. 3. Và 2 D. 2. Và 6.Viết các phương trình hoá học cho những chuyển đổi sau :cr : CrC. P. Cr(OH). P. Cr(OH), l. Na[Cr(OH). 6)CrCl CrClSự ăn mòn sắt, thép là quá trình oxi hoá – khử.a) Giải thích và Viết phương trình hoá học của phản ứng xảy ra khi sắt, thép bị ăn mòn. b) Kẽm hoặc thiếc tráng ngoài vật ắt, thép. Có tác dụng bảo vệ sắt khỏi bị Hãy giải thích một thực tế là sau một thời gian sử dụng thì vật được tráng bằng kẽm Có hiệu quả bảo vệ tốt hơn vật được tráng thiếc.Ludi TIUJ > dilBiết : Eo,Zጠ*” 12ጠ –0,76V; Eo =-0,44V, 터 – 0,14.V.Fe2 Fe n2/Sn c). Vì sao thiếc được dùng nhiều hơn kẽm để bảo vệ kim loại dùng chế tạo hộp đựng thực phẩm. Còn kẽm lại được dùng nhiều hơn thiếc để bảo vệ ống dẫn nước, xô, chậu,…?Từ Fe, hãy trình bày 3 phương pháp điều chế trực tiếp muối FeSO4. Viết các phương trình hoá học. Từ hỗn hợp Ag và Cu, hãy trình bày 3 phương pháp hoá học tách riêng Ag và Cu. Viết các phương trình hoá học. Xác định Công thức của oxit sắt. Dung dịch A là FeSO4 có lẫn tạp chất Fe2(SO4)3. Để xác định nồng độ mol của mỗi chất trong dung dịch A, người ta tiến hành những thí nghiệm sau :Thí nghiệm 1 : Thê 4۔ ح۔ مردسے g di – – – – – – – g di l- A mill-mara ta’ dư, đun nóng Lọc lấy kết tủa, nung trong không khí ở nhiệt độ cao tới khi khối lượng không đổi, được chất rắn duy nhất có khối lượng 1,2 gam. Thí nghiệm 2: Thêm vài giọt dung dịch H2SO4 vào 20 ml dung dịch A, rồi nhỏ dần từng giọt dung dịch KMnO4 vào dung dịch trên, lắc nhẹ. Khi dung dịch Có màu hồng thì ngừng thí nghiệm, người ta đã dùng hết 10 ml dung dịch KMnO40,2M. a) Giải thích quá trình thí nghiệm và viết các phương trình hoá học. b) Tính nồng độ mol của mỗi chất có trong dung dịch A ban đầu. C) Bằng phương pháp hoá học nào có thể loại bỏ được tạp chất trong dung dịch A ban đầu ? Viết phương trình hoá học của phản ứng đã dùng.223
