Xem toàn bộ tài liệu Lớp 8: tại đây
- Giải Hóa Học Lớp 8
- Giải Sách Bài Tập Hóa Lớp 8
- Sách giáo khoa hóa học lớp 8
- Sách Giáo Viên Hóa Học Lớp 8
- Sách Bài Tập Hóa Học Lớp 8
Đề kiểm tra 1 tiết Hóa học 8 Chương 5 (Đề 3)
Câu 1: Để điều chế khí hiđro trong phòng thí nghiệm, người ta có thể dùng kim loại kẽm, magie, nhôm cho tác dụng với axit clohiđric hoặc axit sunfuric loãng. Nếu lượng khí hiđro sinh ra bằng nhau trong mỗi trường hợp thì dùng kim loại nào phản ứng với axit nào sẽ có khối lượng chất tham gia phản ứng nhỏ nhất?
Câu 2: Hòa tan hoàn toàn 44,8 lít khí SO2 (đktc) vào nước dư, người ta thu được dung dịch axit sunfurơ. Cho vào dung dịch này một lượng dư muối BaCl2. Tính khối lượng kết tủa tạo thành.
Câu 3: Dùng khí hiđro dư để khử x gam sắt(III) oxit, sau phản ứng người ta thu được y gam sắt kim loại. Nếu dùng lượng sắt này cho phản ứng hoàn toàn với axit clohiđric có dư thì thu được 5,6 lít khí hiđro đo ở điều kiện tiêu chuẩn.
a) Viết các phương trình phản ứng hóa học.
b) Hãy xác định giá trị x, y và lượng muối sắt(II) clorua tạo thành sau phản ứng.
Câu 4: Dùng khí hiđro để khử hoàn toàn 6 gam một oxit sắt thì thu được 4,2 gam Fe. Tìm công thức phân tử của oxit sắt.
Đáp án và Hướng dẫn giải
Câu 1: 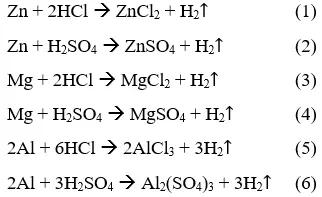
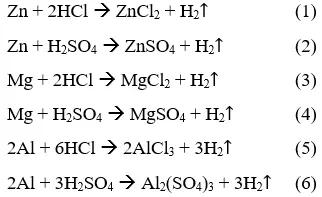
Đặt số mol hiđro sinh ra là a, ta dễ dàng tính được số mol của từng kim loại và của từng axit. Từ đó tính ra khối lượng của chúng và sẽ thấy được chỉ ở phản ứng (5) khối lượng Al và khối lượng HCl là nhỏ nhất.
Câu 2: Phản ứng: SO2 + H2O H2SO3 (1)
H2SO3 + BaCl2 → BaSO3↓ + 2HCl (2)
Từ (1) và (2) suy ra: nBaSO3= nSO2= 44,8/22,4 = 2 (mol)
→ mBaSO3= 2 x 217 = 434 (gam).
Câu 3:
Các phương trình phản ứng hóa học:
Fe2O3 + 3H2 −to→ 2Fe + 3H2O (1)
Fe + 2Hcl → FeCl2 + H2 (2)
Từ (2): nFe = nH2= 6,72/22,4 = 0,3 (mol)
→ y = mFe = 0,3 x 56 = 16,8 (gam)
Từ (1): nFe2O3= 1/2 nFe= 0,3/2= 0,15 (mol)
→ x = mFe2O3= 0,15 x 160 = 24 (gam)
Từ (2): nFeCl2= nFe = 0,3 (mol) → mFeCl2= 0,3 x 127 = 38,1 (gam)
Câu 4: Đặt công thức phân tử của oxit sắt là FexOy (sắt có hóa trị 2x/y)
